Podemos escribir la entropía en notación más compacta como
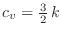
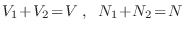 0 \;. $">
0 \;. $">![$\displaystyle \fbox{ $\displaystyle S = \frac32 Nk\left(\frac53 + \ln\fr... ...ht) + Nk \ln\left(\frac VN u^{3/2}\right) \rule[-1.75em]{0em}{4em} $ } $](http://www.famaf.unc.edu.ar/~gcas/termo2/clases/img487.png)
Podemos escribir la entropía en notación más compacta como
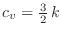
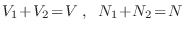 0 \;. $">
0 \;. $">![$\displaystyle \fbox{ $\displaystyle S = \frac32 Nk\left(\frac53 + \ln\fr... ...ht) + Nk \ln\left(\frac VN u^{3/2}\right) \rule[-1.75em]{0em}{4em} $ } $](http://www.famaf.unc.edu.ar/~gcas/termo2/clases/img487.png)
Cualquier escala definida siempre depende de un tanto de las propiedades específicas del material empleado. Para establecer una escala en verdad independiente del material, necesitamos desarrollar algunos principios de termodinámica. El principio de en termómetro de gas muestra que la presión de un gas a volumen constante aumenta con la temperatura. Para calibrar el termómetro, medimos la presión a dos temperaturas digamos a 0 y a 100, graficamos esos puntos y trazamos una línea recta entre ellos. Así podemos leer de la grafica la temperatura correspondiente a cualquier presión. Si extrapolamos la línea, veremos que hay una temperatura hipotética -273.15 ºC en la que la presión absoluta del gas seria cero.
La escala de temperatura Kelvin, así llamada por el físico ingles Lord Kelvin (1824-1907). Las unidades tienen el mismo tamaño que las de escala Celsius, peor el cero se desplaza de modo que 0 K = -273.15 y 273.15 K = 0ºC
Tk = Tc + 273.15
Definimos el cociente de cualesquier dos temperaturas T1 y T2 en la escala Kelvin como el cociente de las presiones correspondientes de termómetro de gas p1 y p2
La escala Kelvin se denomina escala de temperatura absoluta y su cero se llama cero absoluto.